
BIOLOGÍA Y MICROBIOLOGÍA AMBIENTAL
Rosa Leonor Acevedo Barrios (CV)Carlos Alberto Severiche Sierra (CV)
Marlon Enrique Castillo Bertel (CV)
Universidad de Cartagena
-
RECUENTO DE Aeromonas sp.
Las Aeromonas son habitantes normales de los ambientes naturales acuáticos en todo el mundo. Morfológicamente son coco bacilos o bacilos cortos Gram negativos, anaerobios facultativos, además fermentan la glucosa y la trehalosa, son citocromooxidasa positiva e indol positivo. Su importancia radica en que están asociadas a infecciones intestinales en humanos. Este procedimiento aplica para todo tipo de aguas, que no tengan altas turbiedades.
Objetivo
Describir el procedimiento para el recuento de Aeromonas sp. en muestras de agua, por el método de filtración por membrana.
Equipos, Materiales y Reactivos
Frascos en borosilicato para la preparación de medios de cultivo, con tapa rosca resistente a la esterilización, Cajas de Petri desechables estériles, en material plástico, de aproximadamente 50-60 y 90 mm de diámetro, Membranas de filtración estériles, de 47 mm de diámetro y poro de 0.45 mm, Pipetas mecánicas de diferentes volúmenes y puntas estériles acorde a la pipeta seleccionada, Horno microondas, Autoclave, Cabina de flujo laminar, Equipo de filtración, Incubadora a temperatura de 35 ± 1°C, Contador de colônias, Gradillas resistentes a la esterilización, Tubos de ensayo con tapa rosca, Agua estéril para dilución o lavado: destilada o peptonada al 0.1%, Medio de cultivo: Agar Selectivo para Aeromonas, para el crecimiento inicial de las colonias, Tiras reactivas para determinación de citocromoxidasa, Reactivo de Kovac´s Medio de Cultivo Chromocult Ò Merck o Medio SIM , Agar MacConkey, Agar nutritivo D-(+)-Trehalosa dihidrato, Parafina, Para la preparación de los medios de cultivo, siga las instrucciones del fabricante.
Procedimiento
Para la recolección de muestras se utilizan frascos de vidrio o plástico, tapa rosca o esmerilada. Las condiciones ambientales de temperatura y humedad, no son críticas para la realización de este ensayo. la dilución (de ser necesaria) y la siembra de la muestra, deben realizarse en la cabina de flujo laminar.
Selección del volumen de muestra a filtrar
Para aguas tratadas y no tratadas con baja turbiedad, la cantidad de muestra a filtrar se establece en un rango de volúmenes que va desde 1 a 100 mL. Para aguas no tratadas con alta turbiedad se utilizan 0.5 mL de muestra. Según la naturaleza de la muestra seleccione el volumen a filtrar, y de ser necesario, haga diluciones adecuadas. Las diluciones inferiores a 0.1 mL deben realizarse empleando factores de 10n, donde n = 1, 2, 3...etc.
Filtración de la muestra
Inicialmente y sin destapar el frasco de la muestra, ésta debe homogeneizarse mediante agitación manual.
Cuando se filtre menos de 50 mL de muestra, agregue 10 mL o más de agua de dilución al embudo antes de adicionar la muestra, con el propósito de conseguir una distribución homogénea de las bacterias sobre el filtro de membrana.
Una vez terminada la filtración de la muestra, enjuague el embudo adicionando de 20 a 30 mL de agua de dilución. Posteriormente, retire los embudos y coloque el filtro de membrana sobre el medio de cultivo. Evite la formación de burbujas o de arrugas en el filtro.
Incubación
Incube las placas en posición invertida a una temperatura de 35 ± 1°C por 24 horas.
Conteo de colonias
Se tendrán en cuenta como sospechosas de Aeromonas sp., todas las colonias de color rosa y transparentes que crezcan en Agar Selectivo para Aeromonas. Si se realizan varias siembras de una misma muestra, cuente preferiblemente aquellas cajas que presentan entre 1 y 30 colonias sospechosas.
Pruebas de confirmación
El número de colonias a confirmar se hará de acuerdo a los siguientes criterios:
Para conteos menores de 5 colonias, confirme todas; para conteos entre 5-50 colonias, confirme por lo menos 5 colonias; para conteos entre 50-100 colonias, confirme el 10%, y para recuentos mayores de 100, confirme 10 colonias.
Repicar en agar MacConkey las colonias sospechosas e incubar a 35 ± 1°C por 24 horas. Transcurrido el tiempo de incubación, las colonias sospechosas en este medio (transparentes o blancas, Lactosa negativa), se repican simultáneamente en agar nutritivo y en agar Chromocult o medio SIM para la realización de las pruebas de oxidasa e indol respectivamente.
Prueba de Oxidasa : Depositar una pequeña porción de las colonias obtenidas en el agar nutritivo en una varilla indicadora de citocromo oxidasa. La aparición de color azul o violeta, indica que la prueba es positiva.
Prueba de Indol : Adicione unas gotas de reactivo de Kovac’s sobre las colonias a examinar en agar Chromocult. La aparición de color rojo a rojo cereza, indica que la prueba es positiva. En caso de realizar la prueba en Medio SIM, adicionar tres gotas de reactivo de Kovac’s en el tubo; la prueba es positiva al formarse un anillo de color rojo en la superficie del medio. Si ambas pruebas (indol y oxidasa), resultan positivas, se realiza la prueba de la trehalosa.
Fermentación de la Trehalosa : Inocule las colonias sospechosas (oxidasa e indol positivas), con un asa en punta en tubos con agar nutritivo enriquecido con trehalosa y rojo de fenol como indicador, adicione parafina líquida para crear una atmósfera de anaerobiosis, e incube a 35°C ± 1°C por 24 horas. La producción de gas y el cambio de color de rojo a amarillo, significan que la prueba es positiva y por lo tanto son Aeromonas sp.
Cálculos y presentación de resultados
La siguiente ecuación permitirá el cálculo de las colonias una vez hayan sido confirmadas como Aeromonas sp.
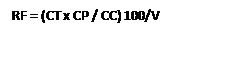
Donde,
RF = Recuento final
CT = Conteo total de colonias
CC = Número de colonias confirmadas
CP = Número de colonias positivas
V = Volumen sembrado (en mL)
Como regla, aproxime al número entero inmediatamente superior, cuando el decimal es mayor o igual a 0.5. Pero mantenga el entero que precede al decimal, cuando este último es menor a 0.5. Realice estas aproximaciones en los resultados finales.
El conteo ideal se realiza en las cajas que presentan entre 1 y 30 UFC sospechosas de Aeromonas sp. Si hay más de una caja con recuentos dentro de este rango, informe el promedio. De no haber cajas en el rango ideal, considérelas todas, incluidas aquellas sin crecimiento.
Si no hay presencia de Aeromonas al filtrar 100 mL de muestra, técnicamente se debería informar como < 1 Aeromonas sp./100 mL. Sin embargo, para propósitos prácticos y evitar confusiones, en los informes emitidos para personal no especializado, informe como 0 Aeromonas sp./100 mL de muestra.
Si se presenta un crecimiento que cubra la totalidad o parte del área de filtración y no se observa claramente separación entre colonias, tomar del filtro una muestra representativa para su confirmación. En función del resultado, se informará: si es positivo, reportar como “crecimiento confluente con Aeromonas”; de ser negativo, reportar como “crecimiento confluente con colonias sugestivas de Aeromonas”. En este último caso, se sugiere repetir la muestra con el fin de confirmar el resultado.
Si el crecimiento de colonias en el medio supera las 200 colonias se reportará como: “Muy numerosas para ser contadas” (MNPC).
Para informes técnicos requeridos en detalle, y en el caso de que se haya procesado menos de 100 mL de muestra y ésta hubiese dado como resultado cero (0) Aeromonas sp., informe el resultado como 0 UFC sobre la cantidad de mL de muestra procesada, -ej. 0 UFC/10 mL.
Informe el resultado de los cálculos como UFC de Aeromonas sp. /100mL.
Para expresar el resultado final y con el fin de evitar confusiones, cuando el valor es hasta de 3 dígitos, repórtelo como se obtuvo; para resultados superiores, expréselo en notación científica usando dos cifras significativas. Este resultado se informa como UFC/100 mL.
Bibliografía
- APHA-AWWA-WEF (2012) Standard Methods for the Examination of Water and Wastewater. 22nd Edition, 9-177 a 179.
- MERCK (200?) Microbiology Manual 12th Edition, Darmstadt, págs. 336-337.
