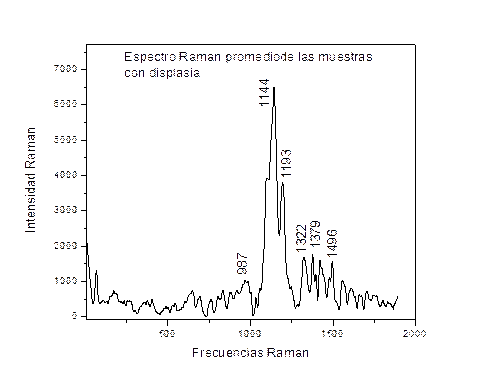UTILIZACIÃN DE LA ESPECTROSCOPIA RAMAN PARA CARACTERIZACIÃN DE DISPLASIAS PROVENIENTES DEL CUELLO UTERINO
R. Ãvila RodrÃguez (CV)
raquel.avila@uaslp.mx
I. CompeÃĄn MartÃnez (CV)
Isaac.compean@uaslp.mx
M.B. Silva CÃĄzares (CV)
macrina.silva@uaslp.mx
J. GonzÃĄlez Contreras (CV)
Universidad AutÃģnoma de San Luis PotosÃ
Resumen
Los diagnÃģsticos clÃnicos de cÃĐlulas provenientes del cuello uterino son muy importantes debido a que es la segunda causa de cÃĄncer. En este estudio se evalÚa el potencial de la espectroscopia Raman para la detecciÃģn de displasia, la cual es un precursor del cÃĄncer. Las muestras colectadas de cÃĐlulas provenientes del cuello uterino fueron analizadas por patologÃa y al mismo tiempo por espectroscopia Raman. Los mÃĐtodos histolÃģgicos tradicionales requieren de reactivos y de una preparaciÃģn especial de la muestra, en cambio, la espectroscopia Raman es una tÃĐcnica Ãģptica que no requiere de reactivos quÃmicos y nos proporciona informaciÃģn de la composiciÃģn bioquÃmica de la muestra, de tal forma que las bandas Raman obtenidas de una seÃąal espectral puede indicarnos la presencia de proteÃnas, aminoÃĄcidos y lÃpidos.
Palabras clave: Cuello uterino, displasia, cÃĄncer, histolÃģgicos, espectroscopia Raman.
Abstract
Clinical diagnosis from uterine cervix cells is so important, because it is the second most common malignancy. This study evaluates the potential of Raman spectroscopy for detection of dysplasia, a precursor to cervical cancer. In this work the samples from uterine cervix cells were analized by pathology and at the same time by Raman spectroscopy. Histological methods required chemical reagents and a special sample preparation, Raman spectroscopy is an optical technique that donÂīt need special chemical reagents, and provide information about biochemical molecular composition of the samples, so the Raman spectral obtained can contain multiples bands due to components such as proteins, amino acids, carbohydrates and lipids.
Keywords: Uterine cervix, dysplasia, cancer, histological methods, Raman Spectroscopy.
INTRODUCCIÓN
El Cáncer Cervicouterino (CaCu), constituye un importante problema de salud pública en especial en los países en desarrollo con un reporte anual de 510,000 casos [1]; su relevancia se encuentra envuelta en una triste paradoja: figura como una de las principales causas de muerte aunque es totalmente prevenible si se detecta oportunamente, el diagnóstico precoz es la intervención sanitaria mas eficiente y costo-efectiva, con una sobrevida a 5 años promedio de 91.5% de los casos de mujeres con cáncer [2].
En México en el 2005, se reportaron 495,240 defunciones, y de estas los tumores malignos ocupan el tercer lugar y el 13.3% corresponde al CaCu impactando directamente en la población femenina. Cada vez es más común ver mujeres jóvenes, de entre 20 y 30 años, que padecen esta enfermedad [3-4]. En el estado de San Luís Potosí para el año 2005 se registró una tasa de mortalidad ajustada de 19.3, con 116 muertes [4], es decir, muere 1 mujer por CaCu cada tercer día.
La infección por el virus del papiloma humano (VPH) es posiblemente una de las infecciones más prevalentes en el mundo, se ha reportado que el VPH representa el 99.7% de los casos positivos de cáncer cervicouterino, y estudios nacionales han reportado que la presencia de VPH de alto riesgo aumenta 78 veces la probabilidad de presentar cáncer cervicouterino [5].
El Virus del Papiloma Humano (VPH) es agente causal del CaCu, lo cual fue establecido desde hace más de 12 años [6]. Hasta el presente, se han reconocido más de 90 tipos de VPH, de los cuales, 35 afectan las mucosas. Estos pueden agruparse de acuerdo al riesgo oncogénico en tipos de: alto riesgo (AR) y bajo riesgo (BR). Estudios diferentes han demostrado que el VPH-AR está presente en más del 99.7% de los carcinomas invasores cervicales [7].
Existen más de 100 tipos de VPH, 30 de los cuales infectan el tracto ano genital femenino y masculino. Los tipos de VPH se clasifican en grupos mucosos y cutáneos. Los del grupo mucoso se clasifican a su vez en tres grupos, en base a su grado de asociación con neoplasia del cérvix uterino:
- Tipos no oncogénicos o de baja oncogenicidad (VPH-BO) 6 y 11, asociados principalmente con verrugas o papilomas genitales; tipos de oncogenicidad media (VPH-MO), 33, 35, 42, 43, 44, 51, 52, y 56, los cuales se encuentran principalmente en lesiones cancerosas premalignas y con menor frecuencia en cáncer invasor; y
- Tipos altamente oncogénicos (VPH-AO) 16, 18, 31, y 45, principalmente asociados con lesiones cancerosas severas e invasoras [8-10].
Después de la exposición a VPH, inicia una fase de incubación que dura 3 meses en promedio (rango 2 semanas a 18 meses), o bien el virus puede permanecer latente indefinidamente. Si se expresa la infección, ocurre una fase de proliferación activa que tarda de 3 a 6 meses, durante los cuales ocurre crecimiento anormal de la capa basal del epitelio escamoso cervical, replicación del ADN viral en las capas medias, ensamble viral, y efectos citopáticos en las capas superficiales. Esto se puede manifestar de diversas formas: como áreas de displasia, como presencia de DNA viral, y/o como papilomas y condilomas. La mayoría de infecciones virales son transitorias, de tal manera que cerca del 50% se resuelven a los 8 meses a 24 meses, y cerca del 20% persisten o recurren.
Como resultado de este proceso, la unión escamocolumnar de la zona de transformación del epitelio cervical sufre alteraciones citopáticas, tales como: koilocitosis, crecimiento nuclear, diskeratosis, multinucleación, y NIC. Estas lesiones pueden persistir, involucionar, o progresar a cáncer invasor.
Varios estudios, demuestran que la infección por VPH-AO es un factor etiológico necesario, aunque no suficiente, de cáncer cervical [10-12]. Actualmente se acepta que el VPH se encuentra en prácticamente todos los casos de cáncer cervical.
El origen del cáncer a nivel de tejido uterino es una enfermedad que se inicia en el epitelio y en un período evolutivo de 10 años se denomina fase preclínica o neoplasia intraepitelian cervical (NIC). Si esta etapa no es alterada en su evolución, pasa a lo que se denomina el cáncer invasivo que es más común en el epitelio escamoso entre el 85 y 95% y en el epitelio columnar de un 5 al 14 % [13]. Los virus oncogénicos, abren la doble hélice del genoma en los puentes disulfuro e intercambian el contenido del ADN con la célula basal del epitelio escamoso, el resultado es una célula con un contenido aneuploide de cromosomas es lo que se denomina una célula neoplásica, es decir células inmaduras, con gran capacidad proliferativa y que en cualquier momento, dependiendo de la agresividad del clon celular y de la respuesta inmune del huésped, puede localizarse, revertir espontáneamente por mecanismos inmunológicos o producir ruptura de la membrana basal generando el cáncer invasivo [14].
En los últimos años se ha presentado un notable incremento en el diseño e implementación de técnicas para la medición de bioseñales, las cuales han permitido el estudio del comportamiento o evolución de patologías en algunos órganos del cuerpo humano.
Son diversos los métodos de diagnóstico de precánceres de cuello uterino utilizados a través del tiempo y ellos han estado ligados a los avances que se han tenido sobre el conocimiento de la fisiopatología, en la carcinogénesis del cuello uterino.
CITOLOGÍA. “La citología vaginal fue introducida por Papanicolaou desde 1928, su contribución fue honrada dándole el nombre de PAP, al nuevo método para el diagnóstico del cáncer de cervical. Otros autores como el patólogo Rumano Babes y el ginecólogo Italiano Viana, sugirieron el uso de la citología vaginal antes que el mismo Papanicolaou, la comunidad científica no dió crédito por lo que los autores suspendieron los estudios, los que se reiniciaron en 1939 mediante los extendidos vaginales realizados con el ginecólogo Herbert Traut, en 1943 publicaron sus hallazgos y conclusiones en la famosa monografía titulada diagnóstico del cáncer uterino por extendido vaginal. La aplicación de este método masivamente a la población ha disminuido en un 80% la mortalidad, sin embargo en nuestro medio las bajas coberturas y las condiciones de pobreza de la población explican la alta mortalidad por esta patología” [15].
Actualmente se usa el sistema Bethesda para el diagnóstico citológico, que hace énfasis en la descripción morfológica y clasifica las lesiones escamosas en LEI de bajo grado (LEI - BG), que comprende las lesiones por VPH y NIC I y LEI de alto grado (LEI - AG), que abarca NIC II y NIC III
COLPOSCOPIA. “La colposcopia fue introducida en 1925 por el profesor Hinnselman, origen Alemán, esta es la parte clínica en el análisis de las alteraciones epiteliales e invasivas del cuello uterino. El colposcopio es un microscopio de bajo poder, al cual se le ha adicionado un filtro verde, para el análisis de los vasos del cuello uterino; este procedimiento estima las alteraciones de los vasos terminales del cuello, donde se reflejan desde una etapa muy temprana los cambios en los tejidos de la neoplasia y valora la extensión clínica de la lesión en el cuello uterino, facilitando la toma de biopsia del sitio más patológico con el fin de planear el tratamiento de una manera individualizada” [15].
HISTOLOGÍA. “La histología se ha utilizado como el diagnóstico definitivo de las lesiones cervicales y es indispensable para realizar el tratamiento y seguimiento de las pacientes; ésta consiste en el análisis microscópico de una porción de tejido que ha sido extraída bajo el examen colposcópico, en este tejido se observa el epitelio y estroma, donde se ubican las diferentes alteraciones que servirán para el diagnóstico de las alteraciones patológicas. Las lesiones intraepiteliales NIC se encuentran sólo en el epitelio y en un período de 10 a 15 años evolucionan en cáncer invasivo, donde ya hay compromiso del estroma” [15].
La utilización de sondas moleculares de ADN y la reacción en cadena de polimerasa (PCR) en muestras de frotis cervical e hísticas constituyen los métodos de elección para confirmar el diagnóstico y clasificar la infección. En los últimos años se han venido desarrollando técnicas alternativas para la medición de muestras biológicas, como la caracterización de tumores [16], la caracterización de bacterias y anticuerpos en soluciones acuosas por medio de espectroscopías ópticas [17-18]. Una de las técnicas de espectroscopía que ha demostrado tener potencial para aplicaciones del área biomédica, es la espectroscopía Raman [19], ya que es posible realizar mediciones sobre muestras sólidas, líquidas o gaseosas, sin que estas requieran de reactivos químicos o de alguna preparación especial [20-21]. Los espectros Raman de muestras biológicas exhiben bandas bien definidas correspondientes a los modos de vibración molecular, por lo que es posible realizar el análisis de mezclas ya que cada especie molecular en la mezcla, exhibe un espectro Raman característico.
La espectroscopía Raman es una técnica fotónica de alta resolución que se basa en hacer incidir un haz de luz monocromático sobre la muestra a analizar, una pequeña fracción de esta luz es dispersada inelásticamente experimentando cambios en frecuencia, estos cambios son los que nos proporcionan información química y estructural de la muestra analizada. Es importante mencionar que la magnitud del desplazamiento Raman es independiente de la longitud de onda de excitación. Una ventaja importante de la espectroscopia Raman es el hecho de que el agua no produce interferencias y, por tanto es posible obtener espectros Raman de fluidos biológicos [22].
OBJETIVO
Utilizar la espectroscopia Raman como una herramienta para la caracterización de los cambios bioquímicos relacionados con la aparición de displasias en células provenientes del cuello uterino.
METODOLOGIA
Las muestras de tejido cervicouterino fueron colectadas de 10 pacientes que acuden a la prueba de Papanicolaou del centro de salud de Ahualulco, N° 100 de la jurisdicción N° 111 perteneciente a Soledad de Graciano Sánchez, San Luís Potosí. Las muestras se procesaron en el laboratorio de patología del Hospital Central “Dr. Ignacio Morones Prieto” de S.L.P. Se colectaron muestras dobles por paciente, una para el análisis de patología y la otra para la medición con espectroscopia Raman, de las cuales los resultaros de Patología arrojaron 8 como sanas y dos con un grado leve de displasia, las mismas muestras se midieron con raman tomando 3 espectros por muestra, para asegurarse de la repetitividad de la medición.
Los espectros resultantes fueron procesados aplicando la línea base, quitando ruido, y obteniendo un espectro promedio de los espectros con displasia y los sanos. Se utilizó el software Origin versión 8.0 y Mathlab 9.0 para el procesamiento de las señales espectrales.
El equipo de espectroscopia Raman consiste en una fuente de Luz de radiación láser de 785nm a 300mW que es la que excita a la muestra, la luz dispersada por la muestra es colectada por un espectrómetro, donde las frecuencias Raman son detectadas por una cámara CCD de 256x1024 pixeles, la cual convierte las señales luminosas en señales eléctricas, para ser procesadas y finalmente observadas en una computadora, como se muestra en la fotografía de la figura 1.

Figura 1. Sistema utilizado en la medición con espectroscopía Raman
RESULTADOS
Los resultados de las mediciones fueron analizados por una comparación visual de los espectros Raman de las muestras sanas y con displasia, con la idea de encontrar diferencias espectrales tales como desplazamientos Raman diferentes, o bien cambios en intensidad, los cuales pueden estar correlacionados con la presencia o ausencia de displasias.
La figura 2 muestra el espectro Raman promedio de las muestras sanas y las muestras con displasia, en la cual podemos observar que existe diferencia en la intensidad Raman, ya que no existen bandas Raman adicionales que se observen en la comparación de los espectros, en la banda centradas en la región 1144cm-1 el espectro de la muestra con displasia es más grande que la muestra sana, estos resultados sugieren que la información contenida en el espectro está relacionada con los cambios de intensidad debido al incremento de células.
Los resultados de citología cervical muestran una relación con los espectros resultantes, ya que los espectros con displasia corresponden a los resultados que arroja el laboratorio de patología indicando cambios en el crecimiento celular.

Figura 2. Cambios en Intensidad Raman debido a cambios en concentración de células.
En la figura 3 se muestra el espectro promedio de las muestras con displasia, donde la frecuencia de 1144cm-1 está relacionada con el modo vibracional C-O, y la de 1322cm-1 con lípidos y proteínas [20].
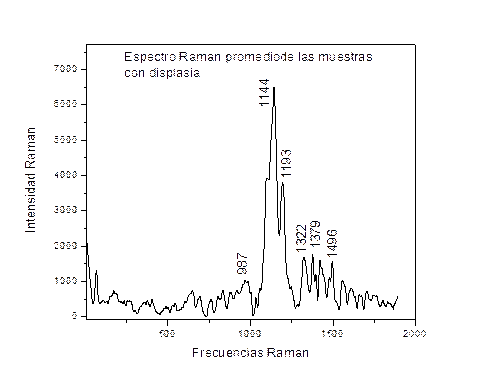
Figura 3. Espectro Raman promedio de las muestras con displasia.
En la tabla 1 se muestran los grupos funcionales asociados a las frecuencias Raman encontradas.
Tabla 1. Asignaciones de los grupos funcionales a las frecuencias Raman.
FRECUENCIA RAMAN (cm-1) |
GRUPO FUNCIONAL ASOCIADO A FRECEUNCA RAMAN |
REFERENCIA |
1144 |
C-O (1300-1000cm-1) |
Norman B.Colthup, Introduction to Infrared and Raman spectroscopy, Academic Press, Inc. Tercera Edición. |
1193 |
P-O (1100-830cm-1) |
Norman B.Colthup, Introduction to Infrared and Raman spectroscopy, Academic Press, Inc. Tercera Edición. |
1322 |
(1291-1324cm-1) Proteínas, lípidos, ácidos nucleicos |
Kurt W.Short, Susan Carpenter, Raman spectroscopy detects biochemical changes, due to proliferation in mammalian cell cultures, Biophysical journal volume 88, 2005 4274-4288. |
1379 |
(1325-1424cm-1)Proteínas, lípidos |
Kurt W.Short, Susan Carpenter, Raman spectroscopy detects biochemical changes, due to proliferation in mammalian cell cultures, Biophysical journal volume 88, 2005 4274-4288. |
987 |
(900-500cm-1)OH, NH y NH2 |
Norman B.Colthup, Introduction to Infrared and Raman spectroscopy, Academic Press, Inc. Tercera Edición. |
CONCLUSIONES
Los espectros Raman analizados del cuello uterino nos proveen información de los cambios bioquímicos, en donde la intensidad Raman de los espectros está relacionada con el crecimiento celular y las regiones espectrales obtenidas se pueden asociar con la presencia de C-O, proteínas, OH, NH, lípidos y ácidos nucleicos; según lo reportado en la literatura [19], en este estudio, la técnica de espectroscopia Raman nos permitió identificar la presencia de displasias en concordancia con los resultados obtenidos de la citología cervical reportados por el laboratorio de patología.
REFERENCIAS
1. López A., Lizano M. Cáncer Cervicouterino y el Virus de Papiloma Humano la historia que no termina. Instituto Nacional de Cancerología de México 2006; 1: .31-55.
2. Ministerio de Salud. Guía Clínica Cáncer Cervicouterino 2. 1st Ed. Santiago: Minsal, 2005.
3. Instituto Nacional de Estadística Geografía e Informática (INEGI). Día mundial contra el cáncer. México D.F., Febrero del 2006.
4. Talavera S. Factores de riesgo asociados a lesiones precursoras de cáncer cervical en mujeres que asisten al centro de salud Tesis de maestría. Managua Nicaragua. Universidad Nacional Autónoma de Nicaragua. Centro de Investigaciones y Estudios de la Salud. Escuela de Salud Pública de Nicaragua; 2006.
5. Cutts F. Franceshi S., Goldie S. Castellsague X, de Sanjose S. Garnett G. et al. Human Papillomavirus and HVP vaccines: a review, Bulletín of the world Health Organization 2007; 85: 719-726.
6. Walboomers JM, Jacobs MV, Manos MM, Bosch FX, Kummer JA, Shaah KV, Snijders PJ, Peto J, Meijer CJ, Munoz N. Human papillomavirus is a necessary cause of invasive cervical cancer wordwide. J Pathol 1999; 189: 12-19.
7. Alvarez M, Chiarelllo A, Espinal E, Reigosa A, Marrero M. Detección de virus papiloma humano (VPH) en grupo de pacientes con sospecha clínica y /o anatomopatológica de infección por VPH. Salud. Rev. de la facultad de Ciencias de la Salud. Universidad de Carabobo 2000; 4 (2):19-26.
8. Richart RM, Masood S, Syrjanen KJ, et al. Human papillomavirus. International Academy of Cytology Task Force summary. Diagnostic Cytology Towards the 21st Century: An International Expert Conference and Tutorial. [Review] Acta Cytol 1998; 42: 50-58.
9. Lorincz AT, Reid R, Jenson AB, Greenberg MD, Lancaster W, Kurman RJ. Human papillomavirus infection of the cervix: relative risk associations of 15 common anogenital types. Obstet Gynecol 1992; 79: 328-337.
10. Schiffman MH, Bauer HM, Hoover RN, et al. Epidemiologic evidence showing that human papillomavirus infection causes most cervical intraepithelial neoplasia [see comments]. J Natl Cancer Inst 1993; 85: 958-964
11. Muller M, Viscidi RP, Ulken V, et al. Antibodies to the E4, E6, and E7 proteins of human papillomavirus (HPV) type 16 in patients with HPV-associated diseases and in the normal population. J Invest Dermatol 1995; 104: 138-141.
12. Shah KV, Viscidi RP, Alberg AJ, Helzlsouer KJ, Comstock GW. Antibodies to human papillomavirus 16 and subsequent in situ or invasive cancer of the cervix. Cancer Epidemiol Biomarkers Prev 1997; 97: 233-237.
13. Pava, R., G. Olarte, B. Rivera, M.T. Vallejo, G.F. Osorio, S.I. Betancur, and G.M. Escobar. Evaluación de un modelo descentralizado para el control del cáncer cervicouterino en el departamento de Caldas, Universidad de Caldas, Manizales 2001.
14. Apgar, B.S., G.L. Brotzman, and M. Spitzer. 2002. Colposcopy principles and practice. W.B. Saunders Company 2002; 167-186.
15. Belarmino Segura G. Espectrospía Óptica de Fluorescencia aplicada al soporte de diagnostico médico de precánceres de tejidos de cuello uterino Tesis Doctoral, Universidad Nacional de Colombia 2009 6 -7.
16. Ferency A., Jenson B. Efectos tisulares y respuesta del huésped. Clínicas de Ginecología y Obstetricia temas actuales, McGraw – Hill 1996 695–714.
17. Ling X.F., Xu Y.z., Weng S.F., Li W.H., Zhi X.U., Hammaker R.M., Fateley W.G., Wang F, Zhou X.S, Soloway R.D., Ferraro J.R. and Wu J.G., “Investigation of normal and malignant tissue sample from the human stomach using fourier transform Raman spectroscopy” Appl. Spectrosc. 56, 2002, 570-573.
28. Mello Cesar, Ribeiro Diórginis, Rapid differentiation among bacteria that cause gastroenteritis by use of low-resolution Raman spectroscopy and PLS discriminant analysis, Anal Bioanal Chem 2005, 383,701-706.
19. Avila R., Araujo C., Frausto Reyes C., Ruiz Facundo, Martínez J.R., Raman Spectroscopy and Chemometrics applied to the study of serum samples with and without antibodies against Toxoplasma Gondii, Research Trends Ref. RT/ASP/72, 2008, 24-25.
20. Baena J. R. and Lendl B., “Raman spectroscopy in chemical bioanalysis,” Current Opinion in Chemical Biology 8, 2004, 534-539.
21. Jimenez-Sandoval S., “Micro-Raman spectroscopy: a powerful technique for materials research,” Microelectronics Journal 31, 2000, 419-427.
22. Skoog D. A., James Holler F., Nieman Timothy A. “Principios de análisis Instrumental”, Editorial Mc Graw Hill 2001, 463.